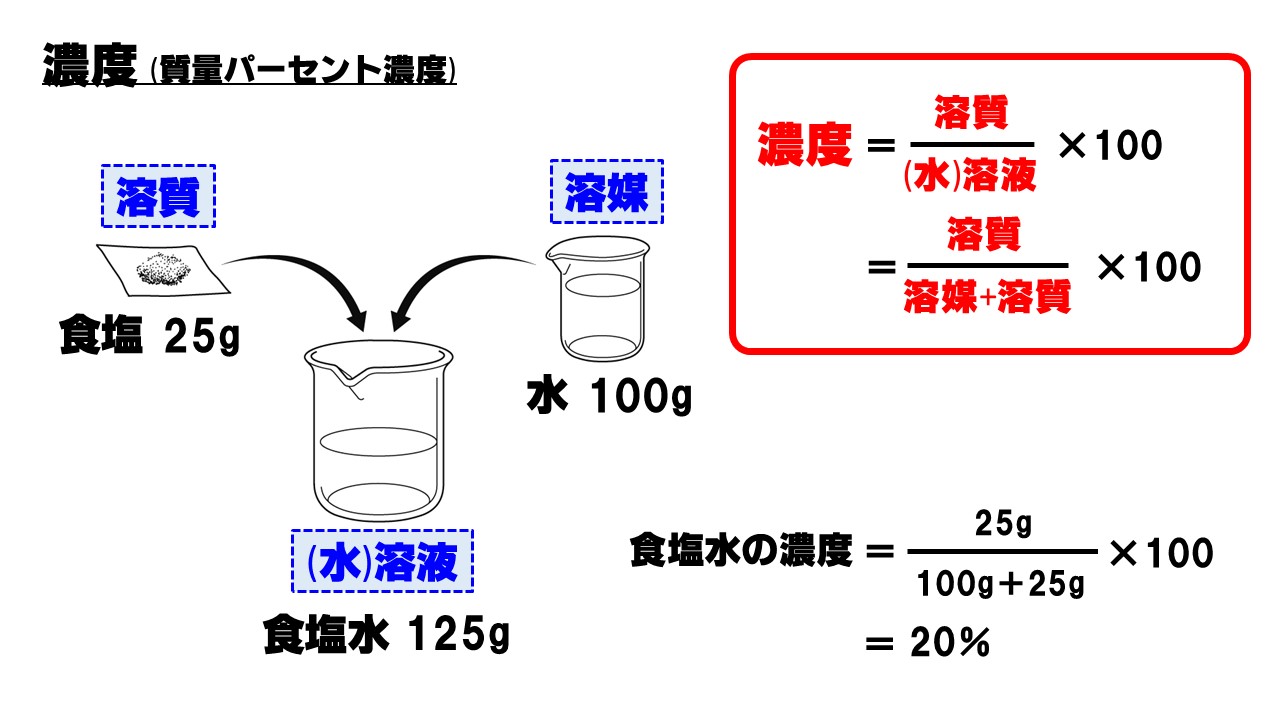
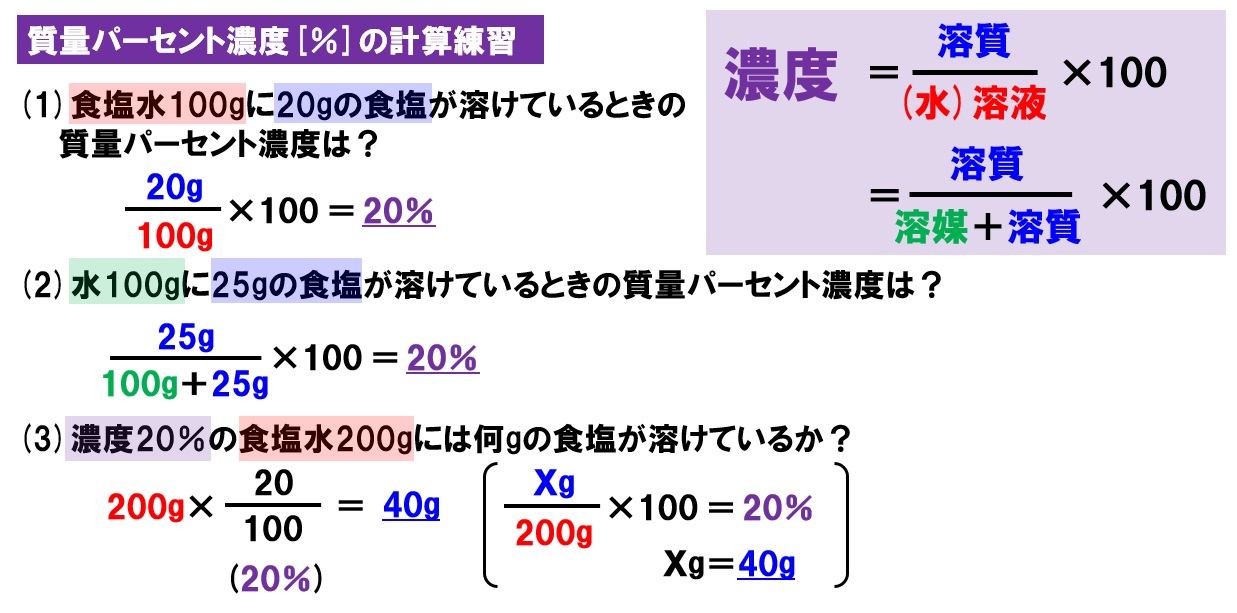
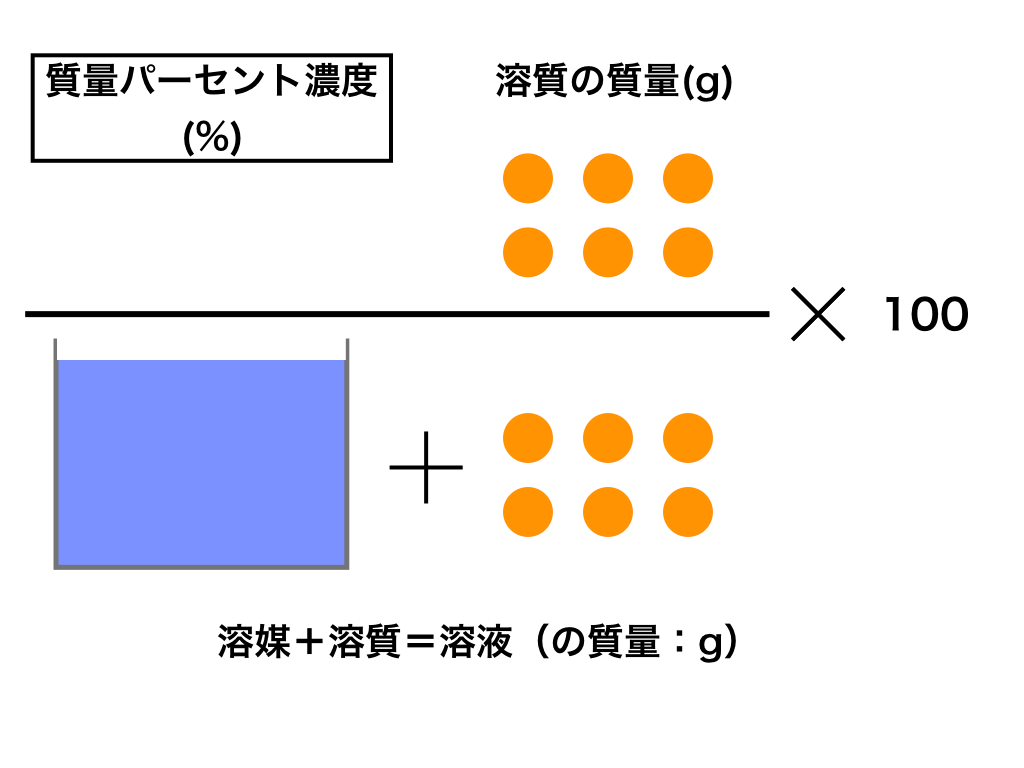
溶質はミョウバンのことであり、質量は40g。水溶液の質量は、ミョウバン(溶質)40 gと水(溶媒)280gを足したもので求められるので、40+280=3g。 質量パーセント濃度(%)= 40(g)÷3(g)×100 = 125% となる。 質量パーセント濃度 水溶液の質量に対する溶質の質量の比を水溶液の濃度といい、濃度を百分率(%)で表したものを質量パ-セント濃度といいます。 <求め方> (※水溶液=水+溶質) 溶解度と質量パーセント濃度の練習問題 問題1 まずは、一問一答水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×100 この値を質量パーセント濃度ともいいます。 単に濃さという場合は、この質量パーセント濃度
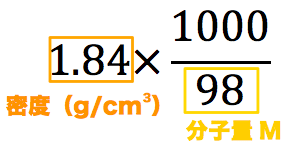
モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
質量パーセント濃度の求め方
質量パーセント濃度の求め方- 最終更新日 wt%とは「重さで考えたときの濃度」 vol%とは「体積で考えたときの濃度」 mol%とは「物質量(モル)で考えたときの濃度」 濃度を表す3つの方法(wt%、vol%、mol%)について、それぞれ意味と計算例を解説します。 目次質量/体積(容積)パーセント濃度の求め方 溶質の質量(g) ÷ 溶液の体積・容積(ml) × 100 = 質量/体積パーセント濃度 % 体積(容積)ml にしめる、溶質の割合を求める方法です。 質量パーセント濃度は、溶液 100g に占める溶質の割合を求める方法ですが、




腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国
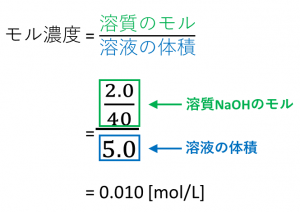
11「溶質」「溶媒」「溶液」について理解しよう 12濃度が違うとはどういうことか? 2濃度の単位と求め方 21質量百分率濃度(%) 22モル濃度( mol / L ) 23質量パーセント濃度とモル濃度の換算 3理解を深める計算問題 31質量パーセント濃度を質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 (1) モル濃度とは、溶質のモル (mol)/溶液の体積 (L)で表される、入試必出の知識です。 本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します
Gの場合であり,w/w% のほかwt% やmass%という表し方もある。単に%の場合は,こ れを指す場合が多い。w/w% = 溶質の質量g 溶液の質量g ×100 で表す。 w/v% は,質量体積パーセント濃度,若しくは質量容積パーセント濃度といい,分子が溶質 の質量 gで分母が溶液の体積mL の場合であり,w/v% = 溶質の質量g 溶液の体積mL ×100 で表す。 v/v%質量パーセント濃度の求め方 *一般的な濃度の計算式です。 質量パーセント濃度 % = 溶質の量 g ÷ 溶液(溶媒+溶質)の量 g × 100 *パーセント(百分率)濃度なので、100倍にします。 つまり、100g(溶液の質量) 中に含まれている溶質の量の割合を一般に,溶液中に含まれる溶質の割合を濃度といい,その表し方には,質量パーセント濃度,モル濃度, 質量モル濃度などがある。濃度に関する出題タイプは,主にⅠ~Ⅶの7つのタイプがある。 例えば,食塩(NaCl)を水(H 2O)に溶かした食塩水を考える。
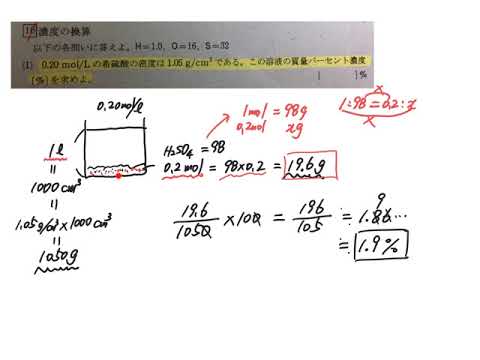
質量パーセント濃度98%、密度184g/cm 3 の濃硫酸(分子量98)のモル濃度を求めよ。 とりあえず密度と分子量を使って計算式を立てる。 基本これを計算すれば終了だが、今回は 質量パーセント濃度の記載があるのでそれを掛ける。 濃度のはなし~中学生向け 質量パーセント濃度について~ 21年2月1日 学習内容解説ブログサービスリニューアル・受験情報サイト開設のお知らせ 学習内容解説ブログをご利用下さりありがとうございます。 開設以来、多くの皆様にご利用いただいて モル濃度のモルは物質量の単位のことです。求め方は以下の通りです。 質量パーセント濃度と式の形は似ていますが、 大きな違いはやはり100倍しないことですね。 というのも、 単位が%ではないので100倍する必要が無いのです。



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
代表的な濃度の表し方4種類を表1に示した. 31 質量パーセント濃度 100 gの溶液を考えたときに,そこに何gの溶質が溶けているかをパーセ ントであらわす方法が質量パーセント濃度である.質量パーセント濃度 こういった元素分析の質量パーセント問題の解き方ですが、質量比を簡単な整数の比に変換できると、楽に解けます。 質量比 c h o = 522 130 358 ≒ 240 60 160 次にモル比に変換します。そのため原子量で除します。 質量比 c h o ≒ 240 60 160 質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
食酢原液の酢酸の質量パーセント濃度を Y 〔%〕とし、食酢原液 1 Lを想定した誘導式は、以下のようになる。 質量パーセント濃度 Y 〔%〕 = × 100 = × 100 = 453 % 実験データの処理(計算例) 溶質の質量「質量パーセント濃度」 溶液の質量に対する溶質の質量の割合を 百分率で示したもの 求め方 質量パーセント濃度(%) 溶質の質量(g) = × 100 溶液の質量(g) 溶質の質量(g) = × 100溶液は、(溶媒溶質 )のことです~ 質量パーセント濃度=溶質の量÷溶液×100 で、求められます!!!




質量 パーセント 濃度 計算 風人




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ
そして質量パーセント濃度の求め方というのは 「質量パーセント濃度(%) 溶質の質量(g) 溶液の質量(g) 溶質の質量(g) 溶質の質量(g)+溶媒の質量(g)」 の式で求めますなので溶け残りは計算しません。 わからない場合はまた聞いてください 質量パーセント濃度16%の塩酸が450gであるから、以下の計算で求めることができます。 質量パーセント濃度16%の塩酸450gには、72gの塩化水素が溶けていることが分かります。 方程式を使う解き方 今回求めたいのは 「加える水の質量」 です。 水溶液は「質量パーセント濃度の求め方」、 状態変化は「水の状態変化」を押さえておけばいいんじゃないかな! 帰国子女(男子) より 18年2月16日 442 AM




腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト
質量パーセント濃度の求め方は、溶質、溶媒、溶液の用語を使って次のように表す 質量体積パーセント(w/v) (重量体積パーセントあるいは質量容積パーセントともいいます) これは溶液100ml中に溶質は何g入っていますか? 質量パーセントと体積パーセントの区別がつきません。 両方とも無次元ということと、質量パーセントの求め方 濃度 (mol/L)*分子量 (g/mol)*密度の逆数 (cm3/g)*単位変更 (dm3/cm3)*100= wt% です。 解る方いらっしゃいましたら、両者の違いと、体積You're signed out Videos you watch may be added to the TV's watch history and influence TV recommendations To avoid this, cancel and sign in to on
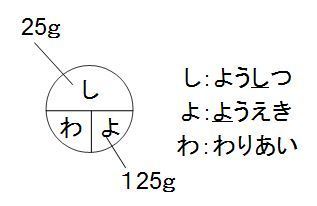



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット
濃度の求め方 同じ塩水でも薄い塩水と濃い塩水があるように溶かした物質が同じものでも、溶かしたものの量によって濃度が異なります。 この溶液の濃さを表すときに使われるのが、重量パーセント濃度です。解説 質量パーセント濃度 = 溶質(g) 溶液(g) ×100より 250 ×100=8 (2)答 250g % 解説 ① 砂糖水(溶液) = 砂糖(溶質)水(溶媒) より 500=250 ② 質量パーセント濃度 = 溶質(g) 溶液(g) ×100より 50 250 ×100= (3)答375% 質量パーセント濃度とは 質量パーセント濃度とは、溶質の質量 gを溶液全体の質量 gで割って100をかけたものです。




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
PH値の求め方 少し数学的に表現するとpHは、つぎのように定義されます。 pH =-logH logとは、対数(ロガリズム)のことで、x=10 n のときnをxの対数といい、n=logxのようにあらわします。 たとえば、log2=は、2=10 ということをあらわしています。 001=10 2 → log10 2 =2 01=10 1 → log10 1 =1 1=10 0 → log10 0 = 0 10=10 1 → log10 1 = 1質量パーセント濃度を求める計算式から、 \(\displaystyle(溶質の質量)=(溶液の質量)\times \frac{(質量パーセント濃度)}{ 100}\) 質量パーセント濃度と 密度と体積 が分かるとき、 公式 質量 パーセント 濃度 求め 方水溶液の濃度 名前 溶液の濃さを、溶質の質量が全体の質量の何%にあたるかで表したものを 何というか。 次の問いに答えなさい。 ① 水 g に食塩 gをまぜると、何%の食塩水になるか。 ② 水 g に砂糖が gとけている。




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




4 質量パーセント濃度の求め方を教えてください Clear
質量パーセント濃度 溶質の求め方 「質量パーセント濃度」の求め方は? ⇒ 楽勝! そして 水溶液の質量 は、 水と砂糖の質量をたせば求める ことができるので、 160 (g)+40 (g)=0 (g) よって、 水溶液の質量 は 0g 。 溶質40g と 水溶液0g の値を、 質量パーセント濃度を求める式 に当てはめると、濃度を示す指標として 質量パーセント濃度 があります。これは、溶液100g中に溶質がどれだけ溶けているかを示すものです。 式で表すと、 質量パーセント濃度=溶質÷溶液×100 となります!後ろに100を掛けているのは、出てきた値を百分率で表したいからです。




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



溶液の濃度計算 薬学 これでok



Q Tbn And9gcrmko2escnl1cjnurstd0t5dmb X3sdynktao5o9vpdvv4txntd Usqp Cau




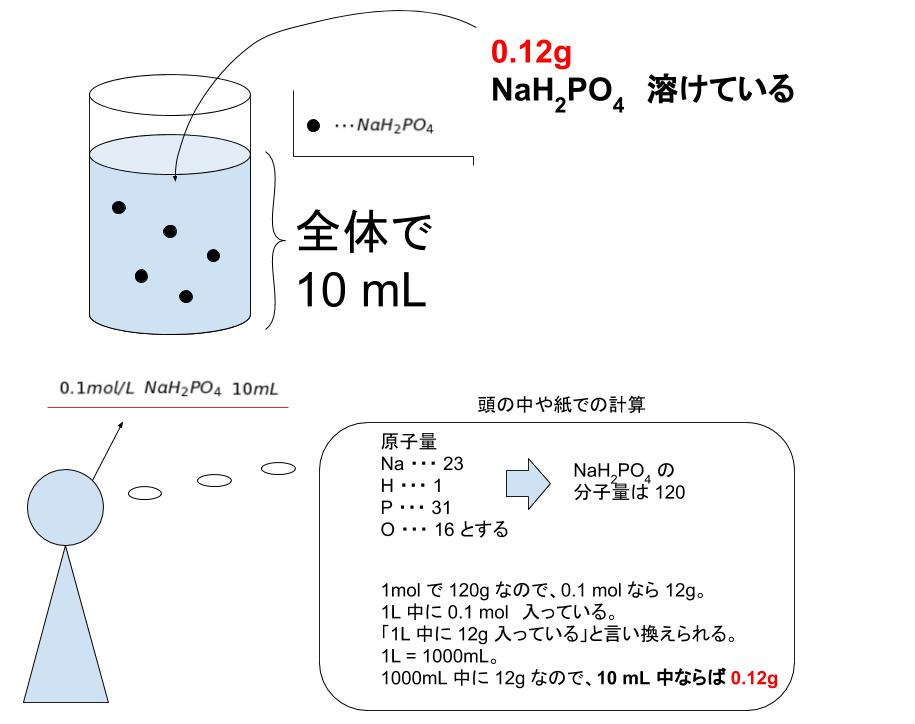
なぜ10mlではなく 1lにしているんですか 教えてください Clear




Telecharger L Image 質量 パーセント 濃度 の 求め 方 2618



中1理科 濃度 質量パーセント濃度 のポイント Examee



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
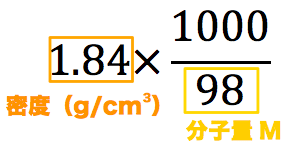



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



N8jvc6g Net Archives 2440




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット
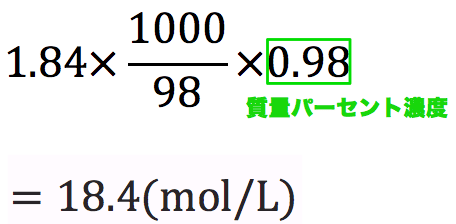



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中1 理科 質量パーセント濃度の計算 P塾




化学 6回目授業 ブログ De 授業 21




理科の パーセント濃度 の計算問題 教えて欲しいです 出来なくて Clear




Q21 Ly P Descubre Como Resolverlo En Qanda



公式を使う
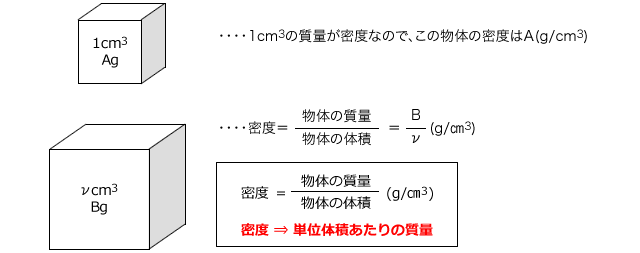



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
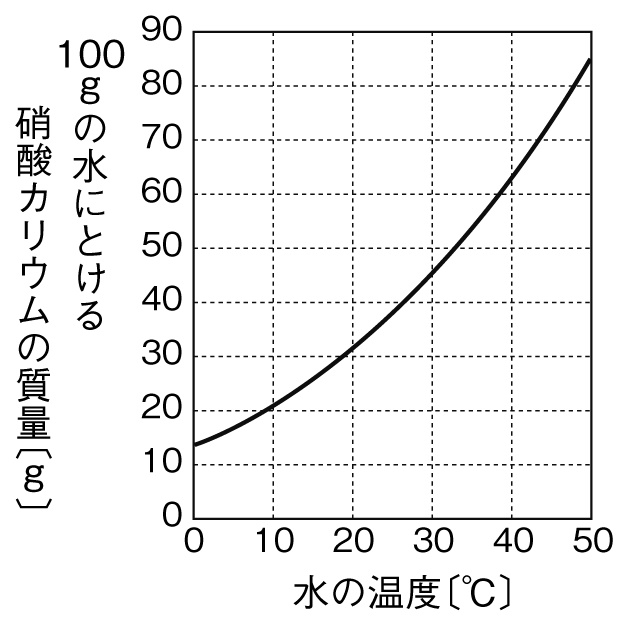



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee



基礎化学3 溶液
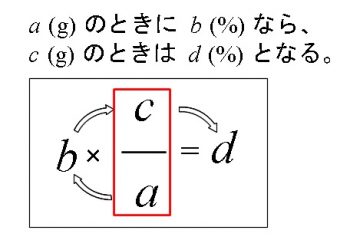



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月
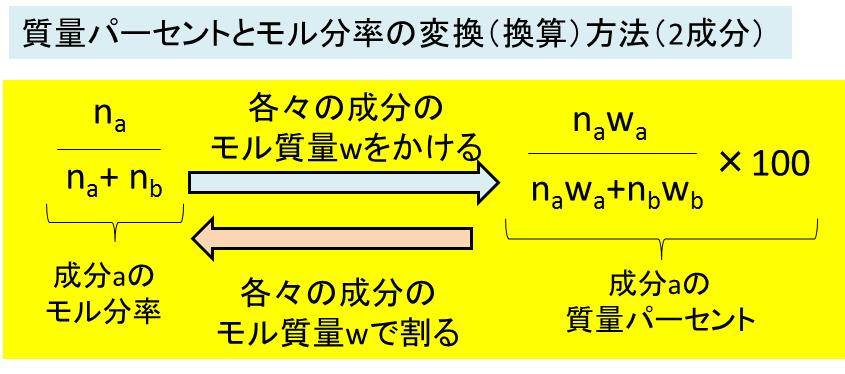



質量パーセントとモル分率の変換 換算 方法 計算




質量パーセント濃度 Okedic
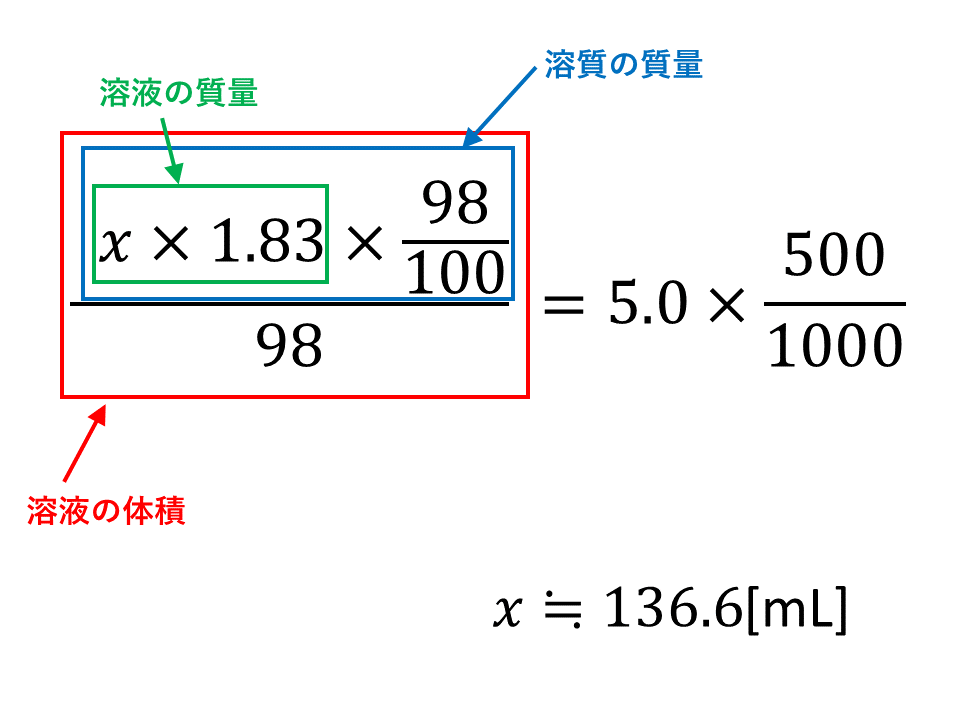



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて
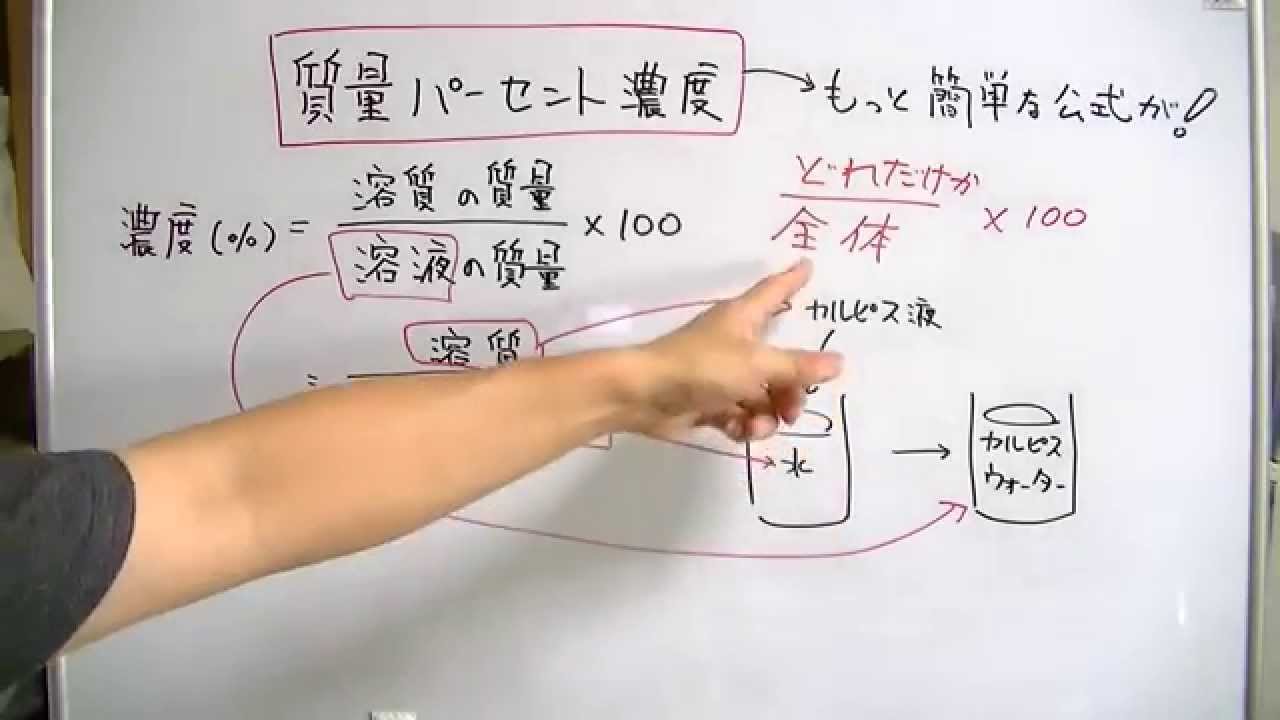



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube



Q Tbn And9gcsb1uq7n3ghpdmmm6bnifzarmojtjzs00fu7ldneg50py0pkw Usqp Cau




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




Wt 重量パーセント Mass 質量パーセント とは 計算方法は 演習問題




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com



質量パーセント濃度




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ



1




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




Cedmzyz Tssvm




質量パーセント濃度の求め方とモル濃度の違い




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



の水100gに塩化ナトリウムを25gとかした時に出てきた水溶液の質量 Yahoo 知恵袋




質量パーセント濃度の計算問題集 応用編 Menon Network




質量パーセント濃度




質量パーセント濃度 密度で求められるのは質量ですか Clear




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
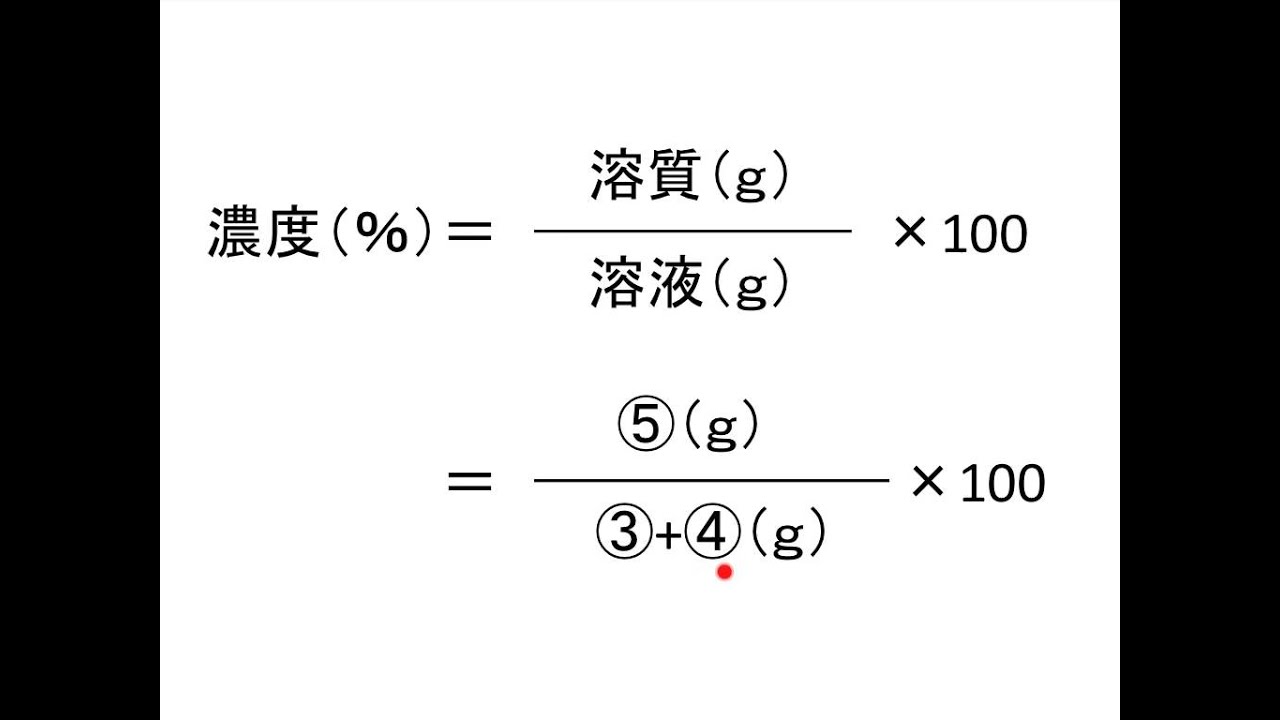



濃度の求め方 絵で覚えよう Youtube




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear



50g15 0g Descubre Como Resolverlo En Qanda




4 6 溶液の濃度 おのれー Note



Q Tbn And9gct5ugrju6fgyyg3ivuopnykcprqdb915pbi5iylny2zus3hrklx Usqp Cau




化学基礎 モル濃度と質量パーセント濃度の計算問題 Tekibo




質量パーセント濃度の問題を計算したのですが どうやっても答えになり 中学校 教えて Goo



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




4 6 溶液の濃度 おのれー Note



溶質を求める




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




中学理科 計算問題 質量パーセント濃度の計算 Youtube



化学です 質量パーセント濃度の求め方を教えてください 約分の仕方 が Yahoo 知恵袋




2 質量パーセント濃度の求め方がわかりません Clear



化学 Mol濃度 質量パーセント濃度 Youtube



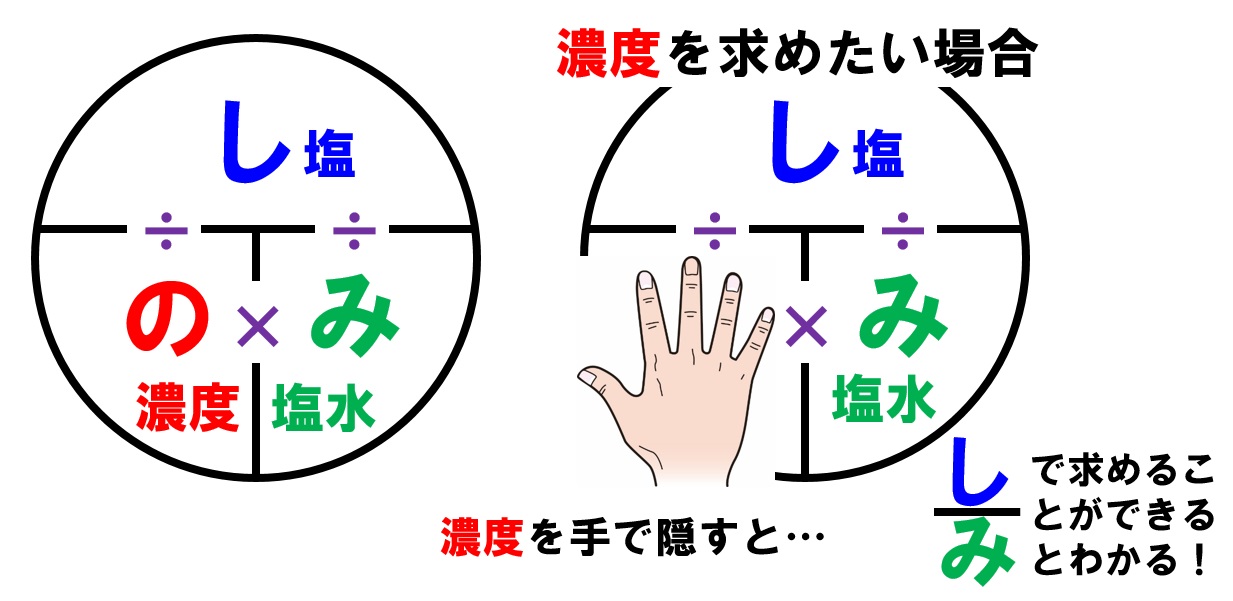
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




質量パーセント濃度の計算問題集 基本編 Menon Network




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン
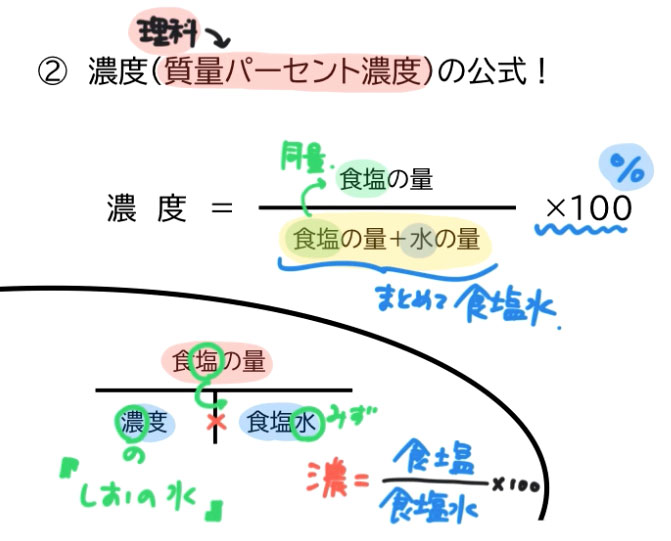



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ




溶液の濃度 無料で使える中学学習プリント




برچسب 質量パーセント濃度 در توییتر




理科 中1 27 質量パーセント濃度 Youtube




中学理科 計算問題 質量パーセント濃度の計算 Youtube




原子百分率の計算方法 備忘録 T Nakaの阿房ブログ




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com



質量パーセント濃度の求め方ってこれであってますか 質量パーセ Yahoo 知恵袋




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




モル濃度とパーセント濃度を脳みそを使わず変換する計算法 化学受験テクニック塾




4 6 溶液の濃度 おのれー Note




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




中1 理科 中1 32 質量パーセント濃度 Youtube




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



濃度の応用
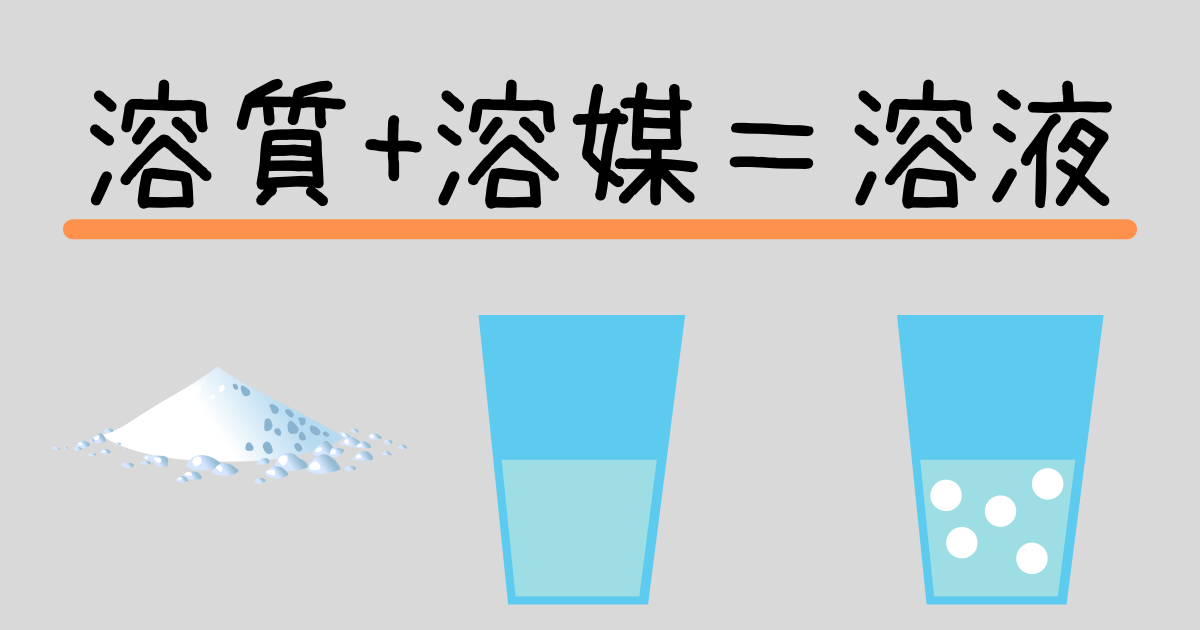



水溶液と質量パーセント濃度の計算問題 Hiromaru Note



0 件のコメント:
コメントを投稿